Plant Cell|我校生命科学学院张钟徽团队在植物ABA信号转导途径研究中取得重要进展
2024年6月26日,国际植物学顶级杂志《The Plant Cell》(IF2024 = 10.0)在线发表了以我校生命科学学院张钟徽研究员为通讯作者的题为《The U-Box E3 Ubiquitin Ligase PUB35 Negatively Regulates ABA Signaling through AFP1-mediated Degradation of ABI5》的研究论文(https://academic.oup.com/plcell/advance-article-abstract/doi/10.1093/plcell/koae194/7699767)。该论文发现了U-Box型泛素连接酶PUB35参与调控ABA信号通路的机制。

生物体内多种蛋白翻译后修饰之间存在交互应答,泛素化和磷酸化是生物体内普遍存在、且十分关键的两种蛋白翻译后修饰,两者的交互应答是研究蛋白质在生物体中如何发挥作用的关键问题。
植物逆境激素脱落酸(Abscisic acid, ABA)的合成、代谢以及信号转导在植物响应逆境胁迫的生理过程中至关重要。拟南芥ABI5是植物亮氨酸拉链(basic Leucine Zipper, bZIP)转录因子家族成员之一,受到ABA和高盐、渗透等逆境胁迫的高度诱导,是ABA信号途径的一个关键调控因子。ABI5受到泛素化和磷酸化等蛋白质翻译后修饰的多重调控。早在2003年,即已发现ABI FIVE BINDING PROTEIN 1 (AFP1)能够与ABI5互作并负调控其蛋白泛素化降解。然而,AFP1究竟通过哪个E3泛素连接酶以及如何调节ABI5的蛋白稳定性是ABA信号途径中一个悬而未决的问题。
该研究鉴定到一个参与ABA响应的U-box型E3泛素连接酶 PUB35,它与AFP1和ABI5都有相互作用。 遗传表型分析表明拟南芥pub35敲除突变体在种子萌发和萌发后的生长过程中对ABA处理及高盐、渗透胁迫敏感,是一个ABA信号的负调控因子。生化及分子生物学分析结果显示PUB35可泛素化修饰ABI5并抑制其蛋白积累,却不能泛素化AFP1蛋白,也不影响其蛋白稳定性。AFP1能够促进PUB35与ABI5在植物体内的互作进而加速PUB35介导的ABI5蛋白泛素化降解。进一步研究表明,ABI5在T201或T206位点磷酸化不仅会抑制其分别与AFP1、PUB35的体内互作,也影响PUB35介导的ABI5蛋白泛素化降解。本文揭示了PUB35和AFP1协同作用负调控ABI5蛋白降解,从而调节种子萌发和萌发后的幼苗生长的分子机制。本研究拓展了对于ABA信号精细调控机制和蛋白翻译后修饰交互应答的认识,也能为农作物干旱和盐碱环境的适应性改良提供理论依据和技术支持。
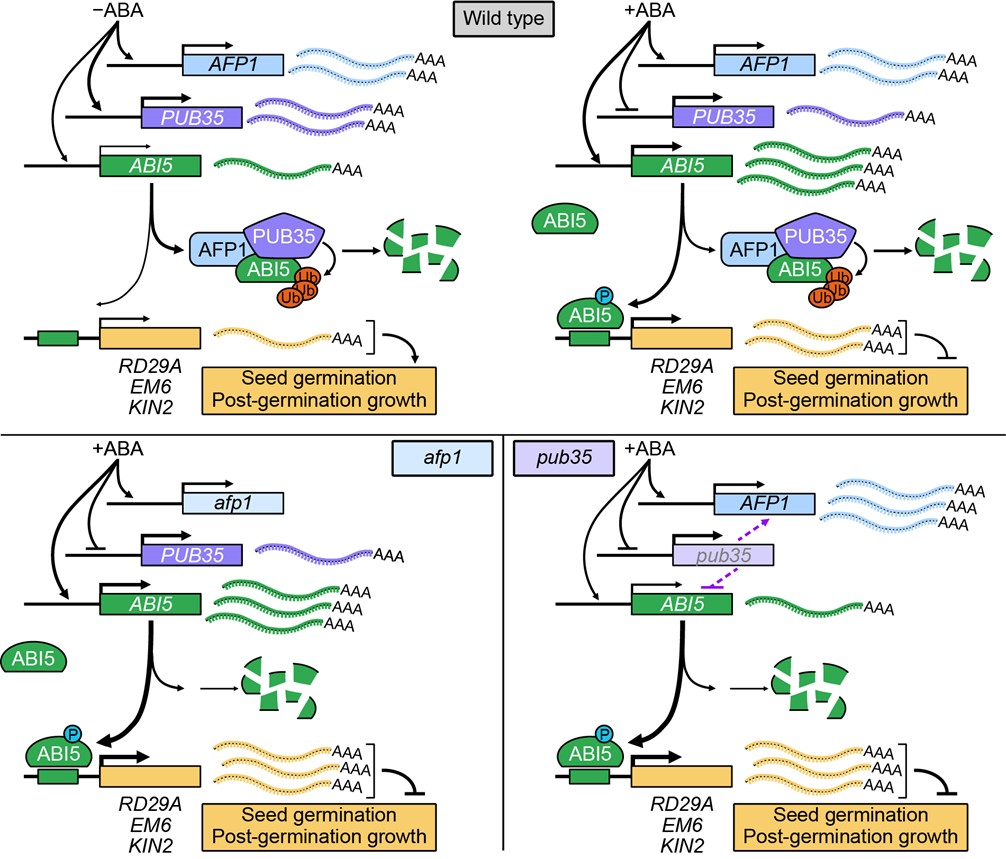
图1 ABA信号途径中PUB35和AFP1协同调控ABI5的泛素化降解
华南师范大学生命科学学院特聘副研究员杜昶博士、刘猛硕士(已毕业)和硕士研究生颜钰洁为论文共同第一作者,华南师范大学生命科学学院张钟徽研究员和聊城大学赵庆臻副教授为共同通讯作者。华南师范大学生命科学学院阳成伟教授、高彩吉教授、黎洪波副研究员也参与了该研究。本研究也得到了华南师范大学生命科学学院赖建彬教授、刘晓诗博士和上海交通大学吕东平教授的大力支持。该项目得到了国家自然科学基金、广东省自然科学基金、珠江人才计划和山东省自然科学基金等项目的资助。